Síndrome de Hiperestimulação Ovariana
Uma complicação possível depois da indução da ovulação para tratamentos de infertilidade é a Síndrome de Hiperestimulação Ovariana, resposta exagerada dos ovários aos hormônios utilizados para maturar os óvulos.
Na parte 1, te explicamos como esse problema se desenvolve e os tratamentos indicados de acordo com a seriedade de cada caso de SHO. Agora, queremos falar sobre as formas de prevenir a Síndrome e, assim, evitar arriscar a saúde da tentante e o cancelamento do ciclo de estimulação ovariana.
Fatores de risco para o desenvolvimento da Síndrome de Hiperestimulação Ovariana
Identificar as pacientes que correm mais riscos de desenvolver a SHO é a principal forma de prevenir esse problema, já que poderemos adequar o tratamento de acordo com as especificidades de cada uma.
Alguns fatores de risco amplamente conhecidos são os seguintes:
- Mulheres com Índice de Massa Corporal (IMC) abaixo de 20, ou seja, que estão abaixo do peso ideal;
- Mulheres com Síndrome de Ovários Policísticos;
- Mulheres com menos de 32 anos;
- Mulheres com histórico prévio de Síndrome de Hiperestimulação Ovariana;
Durante o tratamento, mulheres com altos índices de hormônio antimulleriano ou com mais de 15 folículos maduros também correm mais riscos de desenvolver a Síndrome e devem ser acompanhadas de perto.
Todos esses fatores são observados pela equipe de reprodução assistida para fazer ajustes no tratamento de fertilidade, sempre com o objetivo de preservar a saúde da mulher e possibilitar a gravidez.
Entretanto, como a Síndrome de Hiperestimulação Ovariana pode colocar a vida da tentante em risco, em alguns casos o cancelamento do ciclo poderá ser recomendado.
Cancelamento do ciclo pode ser necessário na SHO
Tecnicamente, o cancelamento do ciclo de estimulação ovariana é a forma mais eficaz de prevenir o agravamento da SHO, mas nunca é fácil tomar essa decisão. A essa altura do tratamento, a mulher já está muito envolvida emocionalmente e financeiramente, e a última coisa que deseja é perder a chance de engravidar.
O uso de protocolos mais seguros como o protocolo antagonista e o trigger ( maturação final dos oócitos) com análogo do GnRH, tem se mostrado altamente eficaz na prevenção da SHO, com raríssimos casos descritos no mundo.
Outra alternativa imediata é chamada de coasting, que consiste na parada temporária de gonadotrofinas enquanto mantemos outros tipos de hormônios. Apesar de ser um grande aliado no controle da Síndrome de Hiperestimulação Ovariana, ainda é associado a menores taxas de gravidez.
Para pacientes em risco mas que chegaram a realizar a coleta de óvulos, pode ser também recomendado criopreservar os gametas ou embriões para uma gravidez em outro ciclo.
Essa medida pode ser interessante para evitar que uma possível gestação agrave mais ainda o quadro de SHO. Além disso, pacientes com a Síndrome possuem níveis elevados de estradiol, o que pode ser prejudicial para o endométrio e também para o embrião.
Sabemos que lidar com a Síndrome de Hiperestimulação Ovariana, principalmente em quadros mais graves, pode ser assustador para a tentante. Justamente por isso, estamos disponíveis para responder todas as suas dúvidas sobre o assunto. É só deixar nos comentários aqui embaixo!
Veja também:
Entenda tudo sobre a Síndrome de Hiperestimulação Ovariana
Histerossalpingografia: o exame que ajuda a avaliar a saúde do útero e das trompas

Entenda tudo sobre a Síndrome de Hiperestimulação Ovariana
Assim como qualquer tratamento médico, a indução da ovulação realizada em processos de reprodução assistida também traz alguns riscos associados. Um deles é a Síndrome da Hiperestimulação Ovariana (SHO), caracterizada pela resposta exagerada dos ovários à estimulação hormonal.
Esse problema, geralmente, é autolimitado, ou seja, se resolve sozinho dentro de uma determinada janela de tempo, mas necessita de acompanhamento porque pode gerar complicações muito sérias.
Na forma leve a moderada, seus principais sintomas são aumento no tamanho dos ovários, distensão ou desconforto abdominal, dor ou cólica, náusea, vômito , inchaço e ganho de peso. Eles são provocados pelo aumento da permeabilidade vascular, gerando acúmulo de líquido na cavidade abdominal e torácica.
Os casos mais leves costumam ser mais comuns, afetando aproximadamente 10% das mulheres tentantes, enquanto os índices para SHO moderadas e graves são de 3% a 6% e 0,5% a 2%, respectivamente.
Além disso, a Síndrome de Hiperestimulação Ovariana também pode ocasionar o cancelamento do ciclo, o que gera muita frustração para a paciente.
Entendendo a Síndrome de Hiperestimulação Ovariana
O hormônio responsável por essa síndrome é o hCG. Ele estimula as células dos folículos ovarianos a produzirem substâncias que fazem com que o líquidos saiam das veias e artérias para o ambiente extravascular.
O hCG é utilizado para maturar os óvulos no processo de estimulação ovariana e costuma ser aplicado de 34h a 36h antes da coleta de óvulos. Chamamos esse hormônio de hCG exógeno.
Entretanto, ele também é liberado no início da gravidez pelas células do tecido que darão origem à placenta, e por isso é o hormônio utilizado como marcador para sabermos se a mulher está ou não grávida. Nesse caso, o chamamos de hCG endógeno.
Portanto, a Síndrome de Hiperestimulação Ovariana pode ser um resultado tanto do processo de reprodução assistida quanto da gravidez em si, mas o hCG endógeno está associado a formas mais graves da doença.
Tratamento e complicações da Síndrome de Hiperestimulação Ovariana
Essa Síndrome pode ser classificada como leve, moderada ou grave, refletindo a quantidade de líquido que se acumula no espaço entre a pele, músculo e demais órgãos.
Por esse motivo, as consequência do problema podem variar bastante, indo desde leve desconforto abdominal causado pelo aumento do tamanho dos ovários a trombose e insuficiência renal.
No quadro leve, a paciente pode perceber uma distensão abdominal, desconforto na região e náusea leve, com ocorrência de vômitos. O tratamento é administração de líquido isotônico, para restabelecer o equilíbrio do organismo e suplementação de proteína.
No quadro moderado, os sintomas são parecidos, mas podem ser mais intensos e a paciente também pode apresentar ascite (barriga d’água). Em alguns casos, é necessário interná-la para administrar medicamentos intravenosos.
Por fim, no quadro grave, a mulher pode apresentar complicações muito mais sérias, como acúmulo de líquido no tórax, ausência ou diminuição drástica do volume de urina, trombose venosa profunda, síncope e rápido ganho de peso.
Nesses casos, costuma ser necessário que a paciente seja internada em UTI e passe por uma drenagem do hidrotórax e da ascite por via vaginal. O quadro é grave, mas é importante se lembrar que esse é um fenômeno bastante raro, e atualmente, praticamente evitável com o uso de protocolos específicos.
Receber todas essas informações pode ser assustador para quem está buscando a reprodução assistida. Além de toda a ansiedade que é comum entre as tentantes, elas precisam também lidar com os riscos associados ao procedimento.
Por isso é tão importante estar amparada por uma boa equipe, que leva em conta as angústias desse processo e vai esclarecer todas dúvidas da paciente, o que sem dúvidas contribui para que ela se sinta mais tranquila.
No próximo post do blog, vamos contar alguns fatores de riscos envolvidos na Síndrome da Hiperestimulação Ovariana e como é possível prevenir o problema. Continue de olho por aqui, ok?
Veja também:
Histerossalpingografia: o exame que ajuda a avaliar a saúde do útero e das trompas
O que é endométrio fino e como tratar para engravidar
Tudo que você precisa saber sobre ácido fólico, seu suplemento antes e durante a gravidez

Reserva ovariana: o que é e como preservar
Quando começamos a investigar o status de fertilidade de uma mulher, um dos primeiros fatores que precisamos levar em consideração é a sua reserva ovariana. Trata-se da quantidade de óvulos disponíveis para amadurecerem e serem liberados durante o ciclo menstrual.
As mulheres nascem com aproximadamente 2 milhões de óvulos e vão perdendo cerca de mil a cada menstruação, de maneira que, ainda na adolescência, costuma sobrar apenas cerca de um terço dos gametas femininos.
Quanto mais o tempo passa, menor é a quantidade de óvulos disponíveis, um processo natural e impossível de se evitar.
É por isso que fica mais difícil engravidar após os 35 anos, quando os óvulos disponíveis são poucos e podem conter erros genéticos causadores de síndromes, má-formações e abortos espontâneos. Ao chegar ao fim da reserva ovariana e a mulher ter a sua última menstruação, dizemos que ela entrou em menopausa.
Entretanto, são muitas as mulheres que descobrem o comprometimento da sua reserva após tentarem engravidar naturalmente por pelo menos um ano, sem obter sucesso. Elas procuram a reprodução humana assistida e realizam uma série de exames, entre eles o anti mulleriano, que rastreia, no sangue, a quantidade do hormônio HAM.
Essa substância é produzida pelos ovários, mais precisamente pelas células da granulosa dos folículos que abrigam cada óvulo. Se estiver em baixa, quer dizer que a reserva ovariana da mulher está diminuída.
Fatores que impactam a reserva ovariana
Apesar de não poder impedir que a reserva ovariana se esgote algum dia, é sim possível adotar algumas atitudes para que a mulher mantenha seus óvulos saudáveis por mais tempo.
Basicamente, é fundamental levar uma vida saudável, evitar o tabagismo, café e álcool em excesso, mantendo uma dieta equilibrada com quantidades adequadas de ácido fólico, vitamina D e ômega 3. Atividade física e manejo de stress também são fundamentais para diminuir a velocidade da perda dos óvulos.
Há, também, casos em que a mulher tem insuficiência ovariana prematura, também conhecida como menopausa precoce, caracterizada pela diminuição drástica na quantidade de óvulos, causando amenorreia antes mesmo dos 40 anos.
Geralmente, é difícil dizer a causa do problema, mas acredita-se que pode estar ligado a doenças autoimunes ou genética. É possível lidar com a menopausa precoce com terapia de reposição hormonal, obtenção de gravidez ainda jovem, tratamento de doenças associadas ou preservação da fertilidade com a reprodução assistida.
Preservando a reserva ovariana com a reprodução assistida
É importante lembrar que, para que uma mulher engravide, ela só precisa que um óvulo saudável seja fecundado. Para quem está com a reserva ovariana baixa e quer engravidar imediatamente, esse pode não ser um problema.
Entretanto, o que acontece com as mulheres que não desejam ou não podem engravidar enquanto possuem uma reserva ovariana suficiente para ter uma ou mais gestações?
Nesses casos, a melhor estratégia é o congelamento de óvulos, a criopreservação. Nesse procedimento, a mulher é submetida, inicialmente, à estimulação ovariana e em seguida à coleta dos óvulos. Depois, esse material coletado recebe uma aplicação de nitrogênio líquido, que congela as amostras a temperaturas que chegam a -196ºC. Assim, mantemos todas as propriedades dos gametas.
Idealmente, o congelamento de óvulos deve ser feito antes dos 35 anos, para garantir uma boa quantidade e qualidade desses gametas, mas nada impede que a mulher passe por esse processo mais tarde, caso queira postergar ainda mais a gravidez.
Entretanto, como explicamos, as chances de problemas com a qualidade dos óvulos são maiores após os 35.

Tudo que você precisa saber sobre o banco de doadores de esperma
O banco de doadores de esperma ou banco de sêmen é uma das alternativas que possibilitam a mulheres ou casais tentantes a realização do sonho de ter um bebê.
Geralmente, esse recurso é procurado por casais homossexuais femininos, mulheres solteiras em busca de produção independente e casais heterossexuais que enfrentam problemas de fertilidade masculina.
A doação de gametas ainda é vista com alguma desconfiança aqui no Brasil e, justamente por isso, precisamos abordar esse assunto com muita seriedade e riqueza de informações, para que aqueles que procuram a reprodução assistida possam tomar suas decisões de maneira segura.
O que é o banco de sêmen
O banco de sêmen é uma espécie de arquivo que reúne amostras do material biológico coletado de doadores voluntários. O sêmen, que contém milhões de espermatozóides, é armazenado em tanques de nitrogênio líquido a -196ºC e chegam a ter 30 anos de validade.
Esse banco reúne, também, diversos dados a respeito do doador, como seu histórico médico, familiar, cor dos olhos, da pele, cabelo, altura, peso, idade, profissão e outras informações. Assim, a mulher ou casal tentante consegue escolher o doador de acordo com seus próprios critérios.
Vale ressaltar, entretanto, que as doações são anônimas e voluntárias de acordo com a legislação brasileira e o Conselho Federal de Medicina.
Quem são os doadores de esperma
Os doadores de esperma são homens que decidem ir até o banco e se oferecerem para integrar o cadastro de voluntários. É necessário ter entre 18 e 50 anos, ser saudável e não pertencer a grupos de risco para doenças sexualmente transmissíveis.
Além disso, o doador também não pode ser portador de doenças genéticas ou ter patologias congênitas graves na família.
Com a decisão tomada, é necessário fazer uma série de testes, como espermograma e exames sorológicos para ter certeza de que o esperma é de boa qualidade e produzirá embriões saudáveis quando for utilizado.
A amostra fica, então, armazenada por um período para observação da janela de manifestação de determinadas doenças. Se estiver tudo certo, o homem entra de forma anônima para o cadastro de doadores.
Porque procurar o banco de doadores de esperma
O banco de esperma costuma ser procurado por mulheres que querem ser mães solo por meio da produção independente, ou seja, engravidar sozinhas sem a participação direta de um homem no processo.
Na maioria dos casos, são mulheres acima dos 35 anos que ainda não encontraram um parceiro para dividir a paternidade, mas que desejam engravidar assim que possível. Geralmente, a preocupação é com a viabilidade dos óvulos, que começa a ficar prejudicada a partir dessa idade.
Outra possibilidade são casais homoafetivos femininos que, sem a doação de esperma, não conseguiriam ter um bebê biológico. Além disso, a reprodução assistida possibilita que elas recorram à gravidez compartilhada, em que uma das mulheres doa o óvulo e a outra gera o bebê.
Casais heterossexuais em que o homem possui alterações graves no sêmen também podem se beneficiar da doação de esperma, realizando uma inseminação artificial intrauterina ou a Fertilização In Vitro com o esperma do doador.
Nos dois primeiros casos, a doação costuma ser encarada de maneira mais tranquila pelas pessoas envolvidas, mas ainda é um desafio, para muitos casais heterossexuais, receber uma doação de gametas.
Por isso, é muito importante que o casal tome essa decisão a partir de muito diálogo, se informando sempre com a equipe médica ou fontes confiáveis.
O sigilo envolvido no banco de doadores de esperma
Muitas pessoas se preocupam com o sigilo em relação à doação de gametas, mas o Conselho Federal de Medicina estabelece que a clínica que realiza o procedimento deve manter o sigilo em relação às identidades do doador e da família que recebeu a doação de esperma.
Ou seja, quando o homem doa seus gametas, não existe a possibilidade de reivindicar a paternidade do bebê gerado a partir do seu esperma.
Outra informação importante é que a clínica deve garantir que cada doador só produza duas gestações de crianças sexos diferentes em uma mesma região.

Análise genética do embrião na FIV: será que é pra você?
Quando uma mulher ou um casal inicia um processo de reprodução humana assistida, muitos esforços são empreendidos para que o objetivo de ter um filho seja alcançado.
Para algumas pessoas, a análise genética do embrião, exame que ajuda a identificar possíveis patologias genéticas, pode aumentar as chances de sucesso da Fertilização in Vitro porque possibilita realizar a implantação somente de embriões saudáveis.
O que é e como funciona a análise genética do embrião
Na FIV, depois que o óvulo é fecundado pelo espermatozóide, o embrião é cultivado em laboratório para se desenvolver até ser possível transferi-lo para o útero materno.
O processo de desenvolvimento de um embrião consiste numa série de divisões e diferenciações celulares, em que possíveis erros podem acarretar alterações cromossômicas causadoras de doenças que, em muitos casos, prejudicam o andamento da gestação.
Entre 5 a 6 dias depois da fecundação, o embrião atinge o estágio de blastocisto, no qual podemos realizar o Teste Genético Pré-Implantacional (PGT), por meio de uma biópsia.
As células embrionárias são retiradas e encaminhadas para análise genética, onde vão passar pelos testes PGT-A ou PGT-M. Em alguns casos, ambos podem ser realizados.
No primeiro, a técnica irá rastrear mais de 100 doenças genéticas, principalmente aquelas relacionadas a alterações no número de cromossomos, como síndromes de Down, Edwards, Turner e Patau, que estão, frequentemente, relacionadas à perda gestacional.
Já o PGT-M vai rastrear doenças hereditárias específicas, que acometem vários membros da mesma família e que possuem altas chances de serem transmitidas para os descendentes, como anemia falciforme, fibrose cística, neuropatias, entre outras.
Depois de avaliados, os embriões euplóides, ou seja, sem alterações genéticas, são selecionados para implantação no útero. Essa medida diminui o risco de abortos espontâneos por alterações cromossômicas, e ou doenças ligadas à má-formação genética.
Para quem a análise genética do embrião é indicada
Esse procedimento pode ser indicado para pessoas com mais chances de terem gametas de má qualidade, como mulheres acima dos 38 anos ou cujos parceiros têm idade avançada ou alterações seminais graves.
Casais que passaram por falhas repetidas de implantação na FIV ou perda gestacional recorrente também podem se beneficiar desse tipo de teste, bem como aqueles que possuem alterações genéticas que podem ser transmitidas para os filhos ou que passaram por falhas repetidas de implantação na FIV.
As vantagens e riscos da análise genética do embrião
As principais vantagens da análise genética do embrião são as menores chances de desenvolvimento de bebês com patologias ou doenças hereditárias por meio da transferência de embriões saudáveis. Assim, aumentamos as chances da gestão ser bem sucedida.
Além disso, muitas mulheres se sentem mais tranquilas ao saberem que escolheram um embrião saudável e que têm mais chances de ter uma gestação tranquila.
Por outro lado, o sequenciamento genético pode revelar que todo os embriões possuem patologias que impedem a transferência, o que seria, também, uma grande decepção. Além disso, o procedimento oferece riscos baixos de inviabilizar o embrião para implantação.
É também importante ressaltar que ainda existe a possibilidade do embrião desenvolver algum tipo de patologia após a transferência, ok?
Agora que você já entendeu melhor esses importantes aspectos a respeito da análise genética de embriões, você já consegue imaginar se ele é ou não indicado para você. De qualquer forma, fique tranquila: quando você começa o seu processo de reprodução assistida, nós do Centro de Reprodução Humana do Mater Dei vamos te fornecer todas as informações necessárias para que você realize o seu tratamento de fertilidade da melhor maneira possível, ok?
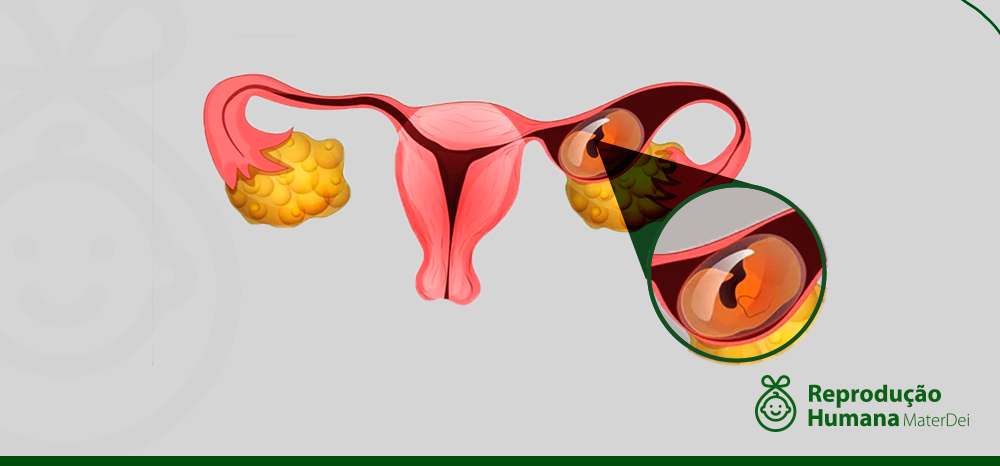
O que é gravidez ectópica e quais os riscos de ela acontecer na FIV
Quando uma mulher se submete a um tratamento de fertilidade, muitos medos costumam surgir: medo de não conseguir engravidar, de ter uma perda gestacional ou alguma complicação durante a gravidez.
É muito importante que ao investir em tratamentos como a Fertilização In Vitro, por exemplo, a paciente esteja ciente das possíveis complicações associadas. Uma delas pode ser a gravidez ectópica, caracterizada pela implantação do embrião fora do útero.
Entenda o que é a gravidez ectópica
No processo de gravidez, tendo ela acontecido naturalmente ou por meio da reprodução humana assistida, o óvulo fertilizado se prende ao revestimento do útero para dar continuidade ao desenvolvimento do embrião.
Numa gravidez ectópica ao invés de o embrião se fixar no endométrio, ele acaba sendo implantado em algum lugar fora dele. Em 98% dos casos, o embrião se desenvolve em uma das trompas, estrutura semelhante a um tubo. Nos 2% restantes, a implantação ocorre em outros locais, como ovário, colo do útero ou na cavidade abdominal.
Uma gravidez ectópica é considerada, na grande maioria dos casos, sem futuro. Isso porque o embrião não consegue se desenvolver normalmente fora do útero e, à medida em que cresce, causa danos às estruturas que o rodeiam. Afinal, o útero está preparado para aumentar de tamanho, não as trompas.
Sem tratamento, esse tipo de gravidez pode colocar a vida da mulher em risco.
Os riscos de gravidez ectópica na FIV
Alguns fatores parecem aumentar as chances da mulher ter uma gravidez ectópica, como inflamações ou lesões na região pélvica e tubária, cirurgias no local, falha na ligadura de trompas, episódio prévio de gravidez ectópica e uso de DIU.
No caso das mulheres que realizam tratamentos de fertilidade como a Fertilização in Vitro, as chances dessa complicação acontecer são baixas ao redor de 1,7%.
Muitas pessoas pensam que a FIV pode impedir a gravidez ectópica porque o embrião é transferido cirurgicamente para o útero da mulher. Entretanto, esse embrião pode se deslocar até outra região e, se as trompas estiverem danificadas, pode ser mais difícil para ele voltar ao útero naturalmente, se implantando no local errado.
Tratamento da gravidez ectópica em mulheres com infertilidade
Infelizmente o tratamento para gravidez ectópica é a remoção do embrião e, dependendo do estágio da gravidez, de parte ou da totalidade da trompa onde ele se desenvolveu.
Como falamos, essa é uma gravidez que não só coloca a vida da mulher em risco como também impede que o feto se desenvolva adequadamente. Por isso o embrião deve ser removido com medicamentos que param o seu desenvolvimento ou numa cirurgia, geralmente realizada por via laparoscópica.
Outra questão é a preservação dos ovários durante a cirurgia, caso a mulher ainda tenha um estoque de óvulos viável para continuar o tratamento de infertilidade.
Quando iniciamos o processo de Fertilização in Vitro levamos em conta todos esses fatores e, inclusive, realizamos uma série de exames após a transferência de embriões para ter certeza de que ele se fixou no local apropriado.
